細胞膜
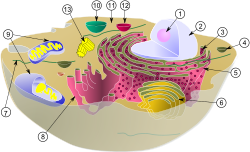
動物細胞の模式図
図中の皮のように見えるものが細胞膜、(1) 核小体(仁)、(2) 細胞核、(3) リボソーム、(4) 小胞、(5) 粗面小胞体、(6) ゴルジ体、(7) 微小管、(8) 滑面小胞体、(9) ミトコンドリア、(10) 液胞、(11) 細胞質基質、(12) リソソーム、(13) 中心体
細胞膜(さいぼうまく、cell membrane)は、細胞の内外を隔てる生体膜で[1][2]、タンパク質が埋め込まれた脂質二重層によって構成される。形質膜や、その英訳であるプラズマメンブレン (plasma membrane) とも呼ばれる。細胞膜は、イオンや有機化合物に対する選択的透過性によって、細胞や細胞小器官への物質の出入りを制御している[3]。それに加えて細胞膜は、細胞接着やシグナル伝達などさまざまなプロセスに関与し、細胞壁やグリコカリックスと呼ばれる炭水化物に富む層などの細胞外構造の接着表面として機能し、細胞骨格と呼ばれるタンパク質繊維の細胞内ネットワークにも関与する。合成生物学の分野では、細胞膜の人工的な再構成が行われている[4][5][6]。

真核生物の細胞膜のイラスト。Cell: 細胞、Extra cellular fluid: 細胞外液、Nucleus: 核、Cytoplasm: 細胞質、Cell membrane: 細胞膜、Carbohydrate: 炭水化物、Glycoprotein: 糖タンパク質、Globular protein: 球状タンパク質、Protein Channel (Transport protein): タンパク質チャネル (輸送タンパク質)、Cholesterol: コレステロール、Glycolipid: 糖脂質、Surface protein: 表在性膜タンパク質、Integral protein: 内在性膜タンパク質、Filaments of cytoskelton: 細胞骨格繊維、Alpha-helix protein: α-ヘリックスタンパク質、Peripheral protein: 周辺タンパク質、Phospholipid bilayer: リン脂質二重層、Phospholipid (Phosphatidylcholine): リン脂質 (ホスファチジルコリン)、Hydrophilic head: 親水性頭部、Hydrophobic tail: 疎水性尾部。

真核生物 (Eukaryote) と原核生物 (Prokaryote) の比較。Membrane-enclosed nucleus: 膜に内包された核、Nucleolus: 核小体、Mitochondrion: ミトコンドリア、Ribosomes: リボソーム、Cell Membrane: 細胞膜、Nucleoid: 核様体、Capsule: 莢膜、Flagellum: 鞭毛、Cell Wall: 細胞壁。
目次
1 歴史
2 構成
2.1 脂質小胞を形成するリン脂質
2.2 炭水化物
2.3 タンパク質
3 機能
4 原核生物の膜
5 構造
5.1 流動モザイクモデル
5.2 脂質二重層
5.3 膜の極性
5.4 膜の構造
5.5 細胞骨格
5.6 細胞内の膜
6 脚注
7 関連項目
7.1 膜タンパク質
7.2 関わる機能等
8 外部リンク
歴史
ロバート・フックは1665年に細胞を発見し細胞説を提唱したが、当時観察可能なのは植物細胞だけであったため、すべての細胞に固い細胞壁が存在すると誤解していた[7]。顕微鏡学者たちは、顕微鏡が進歩するまで150年以上にわたって細胞壁に注目していた。19世紀初頭に植物細胞が分離できることが判明し、各細胞は、細胞壁で結合しているが連結されていない、別個の実体であることが認識されるようになった。細胞説は動物細胞へと拡張され、細胞の保護と成長のための普遍的なメカニズムが示唆された。19世紀後半の時点では、顕微鏡は細胞膜と細胞壁を区別できるほどには発達していなかった。しかし、当時の一部の顕微鏡学者たちは、細胞膜自体の観察は不可能であったものの、細胞の構成要素の運動が外部の影響を受けないことから、動物細胞に細胞膜が存在すること、また、細胞膜は植物細胞の細胞壁に相当するものではないことを推測し認識していた。一方で、細胞膜はすべての細胞に必須の要素ではないとも推測されていた。19世紀の末まで、細胞膜の存在については多くの反論が存在しており、1890年の段階の細胞説では、細胞膜は存在するが副次的構造物に過ぎないとされていた。後の浸透圧と透過性についての研究によって、細胞膜は初めて重要視されるようになった[7]。1895年に、アーネスト・オーバートンは細胞膜が脂質で構成されていると提唱した[8]。
Gorter と Grendel は、細胞膜の構造は水面上の脂質の薄層を模倣した形でなければならないと考えた。さらに、細胞の表面積と脂質が水面に占める面積とを比較し、その比が2:1であると推計した。これによって、今日知られている脂質二重層の最初の基礎がもたらされた。1925年に提唱された仮説[9]では、結晶学と石鹸の泡の観察に基づいて細胞膜の二重層構造を記述する思索がなされた (当時は疎水的相互作用はほとんど理解されていなかった)。この仮説の検証の試みとして、研究者たちは膜の厚さを測定した[7]。1925年に Fricke によって決定された赤血球と酵母の細胞膜の厚さは 3.3 から 4 nm であり、これは脂質一層分に相当するものであった。これらの研究で用いられた比誘電率の選択には疑問があったが、追試で最初の実験の結果を反証することはできなかった。それとは独立して、試料から反射される光の強度を、既知の厚さを持つ膜の標準試料の強度と比較することで非常に薄い膜の厚さを測定する、レプトスコープが発明された。この器具で測定された厚さは、測定pHや膜タンパク質の存在に依存して 8.6 から 23.2 nm の範囲であり、測定結果の下方の値は脂質二重層仮説を支持するものであった。その後1930年代になって、Hugh Davson と James Danielli の膜構造についてのモデル (Davson-Danielliモデル、1935) が一般的に支持されるようになった。このモデルは油と棘皮動物の卵の表面張力の比較に基づいていた。表面張力の値は水-油界面に想定される値よりもかなり低いものであったため、細胞の表面では何らかの物質が界面張力を低下させていることが推測され、2層の薄いタンパク質層の間に脂質二重層が位置すると示唆した。このモデルはすぐに評判となり、シーモア・ジョナサン・シンガーとガース・L・ニコルソンによる流動モザイクモデル (1972) が現れるまで、細胞膜研究において支配的なモデルであった[7][10]。
流動モザイクモデルは1970年代以降、細胞膜の主要な典型的モデルであり続けている[7]。流動モザイクモデルはその後の発見によって現代化され続けているが、その基礎は不変である。膜は親水性の外側の頭部と疎水性の内部から構成され、タンパク質は親水性の頭部と極性相互作用を行い、また膜を完全にまたは部分的に貫くタンパク質は非極性な脂質内部と相互作用する疎水的なアミノ酸を持っている。流動モザイクモデルは、膜の力学についての正確な表現を提供しただけでなく、後に生体高分子の記述の主要なパラメータとなる、疎水的な力についての研究を充実させることにつながった[7]。
構成
細胞膜は、多様な生体物質、特に脂質とタンパク質を含んでいる。その構成は固定されているのではなく、流動性や環境の変化のために常に変化しており、細胞の成長のステージによっても変動する。特に、発生のステージを通じてヒトの一次ニューロンの細胞膜中のコレステロールの量は変化しており、その変化が流動性に影響を与えている[11]。
さまざまなメカニズムで物質は膜へ組み込まれ、そして取り除かれる。
- 細胞内の小胞の膜への融合 (エキソサイトーシス) によって、小胞の内容物が排出されるだけでなく、小胞の膜の構成要素が細胞膜へと取り込まれる。また、膜は細胞外物質の周囲にブレブを形成し、くびれ切れて小胞となる (エンドサイトーシス)。
- 細胞膜が膜成分からなるチューブ状構造と連続しているとき、物質はチューブから膜へと連続的に引き込まれる。
- 細胞膜の構成要素の水相での濃度は低い (安定な膜構成要素が水溶性が低い) ものの、脂質と水相の間での分子の交換は起こる。

膜の主要なリン脂質 (Phospholipids) と糖脂質 (Glycolipids) の例。ホスファチジルコリン (PtdCho)、ホスファチジルエタノールアミン (PtdEtn)、ホスファチジルイノシトール (PtdIns)、ホスファチジルセリン (PtdSer)、スフィンゴミエリン (Sphingomyelin)、グルコセレブロシド (Glucosyl-Cerebroside)。
細胞膜は3つのクラスの両親媒性の脂質を含んでいる。リン脂質、糖脂質、ステロールである。各成分の量は細胞種に依存するが、ほとんどの場合でリン脂質が最も多く、細胞膜の総脂質の50%以上を占めることも多い[12][13]。糖脂質はわずか2%程度と微量であり、残りはステロールである[13]。真核細胞の大部分では、細胞膜の重量組成は脂質とタンパク質がおよそ半分ずつを占める[13]。
リン脂質や糖脂質の脂肪鎖は、通常偶数の炭素原子を含んでいる。典型的には16個から20個の間であり、16または18炭素の脂肪酸が最も多い[14]。脂肪酸は飽和していることも不飽和であることもあるが、二重結合はほとんど常に「シス」型である。脂肪鎖の長さや不飽和度は細胞膜の流動性に大きな影響を与える。不飽和の脂肪は曲がった構造となるため、脂肪酸が互いに密にパッキングすることがなくなり、膜の融点が低下 (流動性が増加) する[12][13]。いくつかの生物は脂質の組成を変えることで細胞膜の流動性を調節する能力を持っており、恒流動性適応 (Homeoviscous adaptation) と呼ばれる[15]。
疎水的な尾部の非共有結合的な相互作用によって、膜全体は維持されている。しかし、構造はきわめて流動的で、どこかの地点に固定されているわけではない。生理的条件下では、細胞膜中のリン脂質分子は液晶状態である。これは、脂質分子は自由に拡散することができ、それらが存在している層に沿った方向へ迅速に拡散することを意味している[12]。一方で、脂質二重層の細胞内側の層と外側の層の間でのリン脂質分子の交換は非常に遅い過程であり、そのため脂質二重層の非対称性は維持される[16]。すべての脂質が迅速に拡散するわけではなく、脂質ラフトやカベオラといったコレステロールに富んだ微小ドメインが細胞膜には形成されている[13]。また、脂質の一部は内在性膜タンパク質と直接的に接触している。タンパク質構造に強固に結合しているものは境界脂質(輪状脂質、boundary lipid、annular lipid) と呼ばれ、タンパク質複合体の一部として振る舞う。
動物細胞では通常、コレステロールはさまざまな程度で細胞膜全体に分散しており、膜脂質の疎水性尾部の間の不定形の空間に位置して膜を硬化し強化している[3]。生体膜中のコレステロールの量は、個体、細胞種、そして個々の細胞間でも異なる。コレステロールは動物の細胞膜の主要な構成要素であり、膜全体の流動性を調節している。すなわち、コレステロールの濃度によって、細胞膜のさまざまな構成要素の運動の量が調節されている[3]。高温では、コレステロールはリン脂質の脂肪鎖の運動を阻害し、低分子の膜透過性を低下させ、膜の流動性を低下させる。低温でのコレステロールの役割はその逆であり、低温に応答してコレステロールの産生はアップレギュレーションされる。低温では、コレステロールは脂肪鎖どうしの相互作用を阻害し、膜の流動性を維持する抗凍結剤として機能する。コレステロールは、温暖な気候に暮らす動物よりも冷涼な気候の動物に多く存在する。コレステロールを持たない植物では、ステロール (フィトステロール) と呼ばれる関連化合物がコレステロールと同じ機能を果たしている[3]。
脂質小胞を形成するリン脂質
脂質小胞またはリポソームは、脂質二重層で取り囲まれたほぼ球形の袋状構造である[17]。これらの構造は、細胞へ直接的に化学物資を搬入することでその細胞への影響を調べたり、細胞膜の透過性についてより詳細な知見を得たり、といった目的で実験室で用いられる。脂質小胞とリポソームは、まず脂質を水溶液に懸濁し、そしてその混合物を超音波によって攪拌することによって得られる[18]。小胞内部から環境中への流出率を測定することで、膜の透過性についてより良い理解が得られるようになった。内部に分子やイオンを含む小胞は、目的物質を含む溶液中で小胞を形成することで得られる。またタンパク質も、目的のタンパク質を界面活性剤の存在下で可溶化し、リポソームを形成するリン脂質と結合させることで膜へ組み込むことができる。このような技術によって、研究者たちはさまざまな膜タンパク質の機能を調べることができるようになった。
炭水化物
細胞膜は炭水化物も含んでいる。それは主に糖タンパク質であるが、糖脂質 (セレブロシドとガングリオシド) も含まれ、真核生物の細胞間認識に重要な役割を果たしている。それらは細胞の表面に位置し、宿主細胞を認識して情報を共有している一方で、ウイルスはこれらの受容体を利用して細胞に結合し感染を引き起こしている[19]。ほとんどの場合、細胞内部の膜では糖鎖修飾は起こらず、一般的には細胞膜の外側の表面が糖鎖修飾されている。グリコカリックスは、すべての細胞、特に微絨毛を持つ上皮細胞の重要な特徴である。グリコカリックスは細胞接着、リンパ球ホーミングや他の多くの過程に参加していることが近年のデータからは示唆されている[19]。ゴルジ体での糖鎖修飾が行われるため、末端から2番目の糖はガラクトース、末端の糖はシアル酸である[20]。シアル酸は負に帯電しており、電荷を持つ粒子に対する外部障壁となっている。
タンパク質
| タイプ | 説明 | 例 |
| 内在性膜タンパク質または膜貫通タンパク質 | 膜を貫通して存在し、親水的な細胞質ドメインを持ち細胞内の分子と相互作用する。疎水的な膜貫通ドメインは細胞膜の内部に存在し、親水的な細胞外ドメインが細胞外の分子と相互作用する。疎水的ドメインは、α-ヘリックスまたはβ-シートからなるタンパク質モチーフが1つまたは複数、もしくはこれらの組み合わせによって構成される。 | イオンチャネル、プロトンポンプ、Gタンパク質共役受容体 |
| 脂質アンカー型タンパク質 | 1つまたは複数の脂質分子に共有結合しており、それらを細胞膜に疎水的に挿入することでタンパク質を固定している。タンパク質自体は膜と必ずしも相互作用しているわけではない。 | Gタンパク質 |
| 表在性膜タンパク質 | 内在性膜タンパク質や、脂質二重層の周縁領域と相互作用している。これらのタンパク質は生体膜と一時的な相互作用しか行わない傾向があり、いったん反応すると分子は解離し細胞質へ移動して機能を果たす。 | いくつかの酵素、ホルモン |
細胞膜は多くのタンパク質を含んでおり、典型的には膜の体積の50%を占める[21]。これらのタンパク質は、さまざまな生物学的活性を担っており重要である。酵母では、約3分の1の遺伝子が膜タンパク質をコードしており、この割合は多細胞生物ではさらに高くなる[17]。膜タンパク質は、内在性、表在性、脂質アンカータンパク質、という3つの主要なタイプから構成される[3]。
右の表に示されている通り、内在性膜タンパク質は両親媒性の膜貫通タンパク質である。これには、イオンチャネル、プロトンポンプ、Gタンパク質共役受容体などが含まれる。イオンチャネルによって、ナトリウム、カリウム、カルシウム、塩素などの無機イオンの電気化学的な勾配に従った拡散が行われる。イオンチャネルの親水的な孔を通ってイオンは細胞膜を通過する。細胞の電気的な挙動 (神経細胞など) はイオンチャネルによって制御されている[3]。プロトンポンプは脂質二重膜に埋め込まれたタンパク質のポンプであり、プロトンはアミノ酸の側鎖を次々に移動しながら膜を越えて移動する。このような電子の伝達やATPの産生にはプロトンポンプが用いられる[3]。Gタンパク質共役受容体は、脂質二重膜を7回貫通する1本のポリペプチド鎖で、シグナル伝達物質 (ホルモンや神経伝達物質) に応答する。Gタンパク質共役型受容体は細胞間シグナリングや、cAMPの産生の調節、イオンチャネルの調節などに用いられる[3]。
細胞膜は外部環境に露出しており、細胞間コミュニケーションに重要な部位となっている。そのため、さまざまな種類のタンパク質受容体や、抗原提示を行うタンパク質などが細胞膜の表面には存在している。膜タンパク質の機能には、細胞間の連絡、表面の認識、細胞骨格の連絡、シグナル伝達、酵素活性、膜を越えた物質輸送なども含まれる。
膜タンパク質はいくつかの方法で膜へ挿入されている。1つの方法では、N末端のアミノ酸の「シグナル配列」がタンパク質を小胞体へ向かわせ、そこで脂質二重層へ挿入される。挿入されたタンパク質は小胞の中で最終目的地まで輸送され、そこで小胞は標的の膜と融合する[22]。
機能

細胞膜の詳細な図解。

細胞膜を通過する物質拡散。Plasma membrane: 細胞膜、Water soluble molecules: 水溶性分子、Fat soluble molecules: 脂溶性分子。
細胞膜は、細胞質を取り囲んでおり、細胞内の構成要素を細胞外の環境から物理的に分離している。また、細胞膜は細胞骨格の足場となって細胞を形づくり、細胞外マトリックスや他の細胞に接着し、まとまって組織を形成する。菌類、細菌、ほとんどの古細菌、そして植物は細胞壁も持っており、細胞の機械的な支持を行うとともに、巨大な分子の通過を防いでいる。
細胞膜には選択的透過性があり、細胞への出入りを調節し、生存に必要な物質の輸送を促進している。膜を越える物質移動は、細胞からのエネルギー入力なしに起こる「受動輸送」と、輸送のために細胞がエネルギーを消費する必要がある「能動輸送」のいずれかによって行われる。また、膜は細胞内外の電位差 (膜電位) を保っている。細胞膜は選択的フィルターとして働き、特定のものだけが細胞へ出入りするようになっている。細胞は、生体膜が関与する輸送メカニズムとして次のようなものを利用する。
- 受動的な浸透と拡散: 二酸化炭素 (CO2) や酸素 (O2) などのいくつかの物質は、拡散によって細胞膜を通過することができ、これは受動的な輸送プロセスである。膜は特定の物質やイオンに対する障壁として働くため、膜の両側では異なった濃度となる。拡散は、低分子やイオンが高濃度側から低濃度側へ自由に移動するときに起こる。このプロセスはエネルギーを必要とせず、膜の両側で作り出された濃度勾配によって推進されるため、受動輸送であると考えられる[23]。半透膜を挟んだ濃度勾配は、水の浸透流を引き起こす。生体における浸透は溶媒の半透膜の通過を伴うが、溶媒は濃度勾配に従って移動しエネルギーを必要としないため、同様に受動的である。細胞内の溶媒は水が最も一般的であるが、他の液体や超臨界流体、ガスであることも可能である[24]。
- 膜貫通チャネルと輸送体: 膜貫通タンパク質は、分子の膜通過のために膜の両側で機能する[25]。糖やアミノ酸のような栄養素は細胞へ入る必要があり、特定の代謝産物は細胞から出て行く必要がある。このような分子は、アクアポリンのようなタンパク質チャネルを受動的に通過して促進拡散されるか、膜貫通輸送体によって膜を越えて汲み上げられる。タンパク質チャネルは透過酵素 (permease) とも呼ばれ、通常は極めて特異性が高く、限られた種類の化学物質だけ (1種類の物質に限られることも多い) を認識して輸送する。膜貫通タンパク質の他の例としては細胞表面の受容体があり、シグナル伝達物質を利用して細胞間のコミュニケーションを行う[25]。
エンドサイトーシス: エンドサイトーシスは、細胞が分子を包み込んで吸収するプロセスである。細胞膜は陥入 (invagination) と呼ばれる、内側への小さな変形を作り出し、輸送される物質がそこへ捕捉される。この陥入は細胞膜の外側に位置するタンパク質によって引き起こされ、それらは受容体のように機能して窪みへ集合し、細胞膜の内側へのタンパク質や脂質の蓄積を促進する[26]。その後、変形部は細胞の内側へくびれて膜から切り離され、捕捉された物質を内側に含む小胞が作り出される。エンドサイトーシスは、固形の粒子を取り込んだり (食作用)、低分子やイオン (飲作用)、高分子を取り込む経路である。エンドサイトーシスはエネルギーを必要とし、そのため能動輸送の一形態である。
エキソサイトーシス: 陥入や小胞形成によって細胞に物質が取り込まれるのと同じように、小胞の膜は細胞膜と融合し、内容物を外部へ排出することができる。これがエキソサイトーシスのプロセスである。エキソサイトーシスは、エンドサイトーシスによって取り込まれた物質の未消化残留物を除去したり、ホルモンや酵素のような物質を分泌したり、物質を細胞の障壁を越えて輸送したりといった目的で、さまざまな細胞で行われる。エキソサイトーシスのプロセスでは、未消化残留物を含む食胞やゴルジ体から出芽した分泌小胞は、まず細胞骨格によって細胞内部から表面へ移動し、小胞の膜と細胞膜が接触するようになる。2つの脂質二重層の脂質分子は互いに組み替えられ、2つの膜は融合する。膜の融合によって通り道が形成され、小胞はその内容物を細胞外へ廃棄する。
原核生物の膜
原核生物は、古細菌と細菌の異なる2つのグループに分類され、細菌はさらにグラム陽性菌とグラム陰性菌に分類される。グラム陰性菌はペリプラズムによって隔てられる細胞膜と外膜を持っているが、他の原核生物は細胞膜のみを持っている。細胞膜と外膜は多くの面で異なっている。グラム陰性菌の外膜は、リン脂質が二重層の外側の面を形成し、リポタンパク質とリン脂質が内側の面を形成している[27]。典型的な外膜は、孔を形成するタンパク質であるポリンのような膜タンパク質が存在するため、孔の多い構造となっている。内側の細胞膜は一般的に対称的な構造をしているが、外膜は上のようなタンパク質のために非対称的である。また、原核生物の膜は、複数の因子が流動性に影響を与えている。流動性に影響を与える主要な因子の1つは、脂肪酸の構成である。例えば、37℃で24時間培養した黄色ブドウ球菌 Staphylococcus aureus の細胞膜は、ゲル状態というよりも流動的な状態となっている。このことは、高温下においては膜はより流動的となるという考えを支持している。膜がより流動的になり安定化が必要となると、より長い、またはより飽和した脂肪鎖が膜の安定化のために合成されるようになる[28]。
また、細菌はペプチドグリカン (アミノ酸と糖) から構成される細胞壁に囲まれている。いくつかの真核生物の細胞も細胞壁をもっているが、それらはペプチドグリカンで作られているものではない。
グラム陰性菌の外膜はリポ多糖に富んでおり、それらは多糖またはオリゴ糖と脂質が結合したもので、細胞の自然免疫を刺激する[29]。ストレス環境や宿主の標的細胞に遭遇し毒性が必要とされるときなどに、外膜はペリプラズム領域へ突起を形成し、毒性細胞小器官 (virulence organelle) として機能する[30]。原核生物の細胞膜には、ニッチへ適合するために構造を適応させている多くの例が見つかる。例えば、ある細菌の細胞表面のタンパク質は滑走運動 (gliding motion) を行っている[31]。多くのグラム陰性菌の細胞膜には、ATPによって駆動されるタンパク質輸送システムが存在する[31]。
構造
流動モザイクモデル
Davson と Danielli のモデルに置き換わって登場した、シーモア・ジョナサン・シンガーとガース・L・ニコルソンによる流動モザイクモデル (1972) によると、生体膜は脂質やタンパク質分子が多かれ少なかれ容易に拡散する二次元液体とみなされている[32]。膜の基礎となる脂質二重層は確かにそれ自体で二次元液体を形成するが、細胞膜には大量のタンパク質も含まれており、それらによってより構造化されたものとなっている。構造の例としては、タンパク質-タンパク質複合体や、アクチンを基礎とした細胞骨格によって形成される picket と fence[33] などがあり、脂質ラフトも含まれる可能性がある。
脂質二重層

脂質二重層を形成している両親媒性の脂質分子の配置の模式図。黄色で示されたの極性の頭部が、水性の細胞質と外部環境から灰色で示された疎水性の尾部を分離している。
細胞膜は通常脂質二重層と呼ばれる構造をつくっている。脂質二重層は自己集合によって形成される。細胞膜を構成する主要な成分であるリン脂質には頭部と尾部があるが、頭部はコリン、リン酸からなり、親水性である。一方、尾部は炭化水素からなり、疎水性である。そのため極性を持つ体液中では尾部を内側に、頭部を外側にするようにリン脂質が二重の膜を形成する。疎水的相互作用 (疎水効果) が脂質二重層形成の主な駆動力である。疎水的な分子間の相互作用が増加し、疎水的な領域が集合すると、水分子はより自由に互いに結合するようになり、系全体のエントロピーは増加する。この複雑な相互作用には、ファンデルワールス力、静電的相互作用、水素結合などの非共有結合的な相互作用が含まれる。細胞膜には、脂質の中に埋め込まれたり、脂質自体に結合した状態のタンパク質(膜タンパク質)が存在し、さらにこの脂質や膜タンパク質には多くの場合糖鎖が結合している。したがって細胞表層は全体として複雑な構造となり、細胞の種類ごとに特徴的なものとなる。
一般的に脂質二重層はイオンや極性分子を透過しない。脂質二重層の親水的な頭部と疎水的な尾部の配置は、一般的に疎水性分子の受動的な拡散を行うが、極性の溶質 (アミノ酸、核酸、炭水化物、タンパク質、イオン) が膜を越えて拡散することは防がれる。そのため細胞は、孔やチャネル、ゲートのような膜貫通タンパク質複合体を経由してこれらの物質の移動させることで、物質移動を制御することができる。フリッパーゼやリン脂質スクランブラーゼは、負電荷を持つホスファチジルセリンを細胞膜の内側に濃縮する[34]。これと、N-アセチルノイラミン酸によって、荷電した分子の膜通過の更なる障壁が形成されている。
膜は真核生物や原核生物の細胞で多様な機能を果たしている。重要な機能の1つは、物質の細胞への出入りを調節することである。特定の膜タンパク質を持つリン脂質の二重層構造 (流動モザイクモデル) は、膜の選択的透過性と受動輸送、能動輸送のメカニズムを説明する。それに加え、原核生物や、真核生物のミトコンドリアと葉緑体の膜は、化学浸透によってATPの合成を促進している。
脂質二重層の例外としては、一部の古細菌の細胞膜がある。例えばスルフォロブス属 (Sulfolobus) 等では向かい合ったリン脂質の疎水鎖が連結し、脂質一重層になっている[35]。
膜の極性
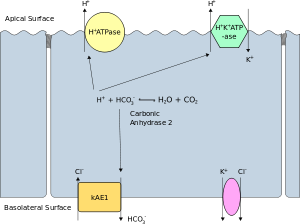
α型間在細胞における物質移動の模式図。Apical Surface: 頂端面、Basolateral Surface: 側底面。
極性を有する細胞において、内腔に面した細胞膜表面は頂端膜 (apical membrane) と呼ばれ、他の面とは異なる活性を持つ。上皮細胞や内皮細胞において顕著であるが、神経細胞のような他の極性細胞でも見られる。極性細胞の側面と底面を形成する細胞膜は側底膜 (basolateral membrane) と呼ばれ、外側の間質に面しており、内腔からは離れている。側面と底面の細胞膜は、特に上皮細胞では、同一の組成と活性を持つ。イオンチャネルやポンプのようなタンパク質は、流動モザイクモデルの通りに底面から側面へ、側面から底面へと自由に移動する。上皮細胞どうしは頂端面の近くでタイトジャンクションによって結合しており、タンパク質の側底膜から頂端膜への移動が防がれている。
膜の構造

細胞膜中の構造物とその機能の模式図。
細胞膜は、カベオラ、シナプス後肥厚、ポドソーム、浸潤突起、焦点接着、さまざまな種類の細胞結合といった「超膜構造」("supramembrane" structure) を形成することができる。これらの構造は通常、細胞接着、細胞間のコミュニケーション、エンドサイトーシス、エキソサイトーシスを担っており、電子顕微鏡や蛍光顕微鏡で観察可能である。これらは、インテグリンやカドヘリンといった、特定のタンパク質から構成されている。
細胞骨格
細胞骨格は細胞膜直下の細胞質に見つかり、膜タンパク質を固定するため、また、細胞から伸びる細胞小器官を形成するための足場となっている。実際に、細胞骨格の構成要素は、細胞膜と密接に相互作用している[36]。アンカータンパク質 (anchoring protein) は膜タンパク質を細胞表面の特定の部位、例えば脊椎動物の腸管に並ぶ上皮細胞では頂端面に限定し、二重層内で拡散する領域を制限している。また、細胞骨格は付属器官型の細胞小器官を形成することができる。例えば繊毛は微小管を基盤とする突起構造であり、フィロポディアはアクチンを基盤とする突起構造である。これらの突起は膜に覆われており、外部環境を感知したり、基質や他の細胞と接触したりするために細胞表面から突出する。上皮細胞の頂端面は微絨毛として知られるアクチンが基盤となった指型の突出が密集しており、細胞の表面積を増加させることで栄養素の吸収率を増加させている。細胞骨格と細胞膜が局所的に脱共役されると、ブレブが形成されることとなる。
細胞内の膜
細胞膜の内側の、細胞の内容物も多数の膜結合性の細胞小器官から構成されており、それらは細胞の全体的な機能に寄与している。
ミトコンドリアと葉緑体は細菌から進化したと考えられており、この考えは細胞内共生説として知られている。この理論は、パラコッカス属とロドシュードモナス属の細菌がミトコンドリアと類似した機能を有しており、藍藻 (シアノバクテリア) と葉緑体と類似した機能を有している、という考えに由来する。細胞内共生説では、真核生物の細胞はこれらの2種類の細菌を飲み込み、細胞内でミトコンドリアと葉緑体が形成されたとされる。これらの細胞小器官の二重の膜構造はこの飲み込みによるもので、その外膜は宿主の細胞膜に由来し、内膜は共生体の細胞膜に由来する。さらに、ミトコンドリアと葉緑体の双方が独自のDNAを持っていることも、これらの細胞小器官が真核細胞に飲み込まれ、細胞内で生育した細菌から進化したことを支持している[37]。- 真核細胞では、核膜が核の内容物を細胞質から分離している[38]。核膜は内膜と外膜から構成され、核への物質の出入りを厳密に調節している。細胞質と核の間の物質の移動は核膜孔を経由して行われる。細胞核での転写が活発になるほど、核膜には多くの核膜孔が形成される。多くのタンパク質は拡散によって核膜を越えることはできないため、核のタンパク質の組成は細胞質とは大きく異なっている。核膜の内部でも、内膜と外膜ではタンパク質の組成は大きく異なる。外膜は小胞体の膜と連続しており、小胞体と同様に外膜にもリボソームが存在し、タンパク質の生産と2つの膜の間の領域への輸送を行っている。核膜は有糸分裂の初期の段階で解体し、末期の段階で再集合する[39]。
小胞体は、細胞内膜系の一部であり、細胞の膜の総量のうちの大きな割合を占めている。小胞体は細管と嚢状構造の閉じたネットワークであり、主要な機能はタンパク質の合成や脂質の代謝である。小胞体には、粗面小胞体と滑面小胞体の2つの種類がある。粗面小胞体はリボソームが付着しておりタンパク質合成に用いられる。滑面小胞体は毒素の処理や細胞内のカルシウムの調節などに主に利用される[40]。
ゴルジ体は、円盤状のゴルジ扁平嚢 (Golgi cisternae) の層が積み重なった構造をしている。ゴルジ体は3つの主要な区画 (シス嚢、中間嚢、トランス嚢) から構成され、複数の細管状・網状のネットワークと小胞によって、全体の組織化、層構造の連結、積み荷の輸送が行われている[41]。
脚注
^ Kimball's Biology pages Archived 2009-01-25 at the Wayback Machine., Cell Membranes
^ Singleton P (1999). Bacteria in Biology, Biotechnology and Medicine (5th ed.). New York: Wiley. .mw-parser-output cite.citation{font-style:inherit}.mw-parser-output .citation q{quotes:"""""""'""'"}.mw-parser-output .citation .cs1-lock-free a{background:url("//upload.wikimedia.org/wikipedia/commons/thumb/6/65/Lock-green.svg/9px-Lock-green.svg.png")no-repeat;background-position:right .1em center}.mw-parser-output .citation .cs1-lock-limited a,.mw-parser-output .citation .cs1-lock-registration a{background:url("//upload.wikimedia.org/wikipedia/commons/thumb/d/d6/Lock-gray-alt-2.svg/9px-Lock-gray-alt-2.svg.png")no-repeat;background-position:right .1em center}.mw-parser-output .citation .cs1-lock-subscription a{background:url("//upload.wikimedia.org/wikipedia/commons/thumb/a/aa/Lock-red-alt-2.svg/9px-Lock-red-alt-2.svg.png")no-repeat;background-position:right .1em center}.mw-parser-output .cs1-subscription,.mw-parser-output .cs1-registration{color:#555}.mw-parser-output .cs1-subscription span,.mw-parser-output .cs1-registration span{border-bottom:1px dotted;cursor:help}.mw-parser-output .cs1-ws-icon a{background:url("//upload.wikimedia.org/wikipedia/commons/thumb/4/4c/Wikisource-logo.svg/12px-Wikisource-logo.svg.png")no-repeat;background-position:right .1em center}.mw-parser-output code.cs1-code{color:inherit;background:inherit;border:inherit;padding:inherit}.mw-parser-output .cs1-hidden-error{display:none;font-size:100%}.mw-parser-output .cs1-visible-error{font-size:100%}.mw-parser-output .cs1-maint{display:none;color:#33aa33;margin-left:0.3em}.mw-parser-output .cs1-subscription,.mw-parser-output .cs1-registration,.mw-parser-output .cs1-format{font-size:95%}.mw-parser-output .cs1-kern-left,.mw-parser-output .cs1-kern-wl-left{padding-left:0.2em}.mw-parser-output .cs1-kern-right,.mw-parser-output .cs1-kern-wl-right{padding-right:0.2em}
ISBN 978-0-471-98880-9.
- ^ abcdefgh Molecular Biology of the Cell (4th ed.). New York: Garland Science. (2002).
ISBN 978-0-8153-3218-3. オリジナルの2017-12-20時点によるアーカイブ。. https://www.ncbi.nlm.nih.gov/books/NBK21054/?term=Molecular%20Biology%20of%20the%20Cell.
^ Budin, Itay; Devaraj, Neal K. (December 29, 2011). “Membrane Assembly Driven by a Biomimetic Coupling Reaction”. Journal of the American Chemical Society 134 (2): 751–753. doi:10.1021/ja2076873. PMC: 3262119.
PMID 22239722. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3262119/.
^ Staff (2012年1月25日). “Chemists Synthesize Artificial Cell Membrane”. ScienceDaily. 2012年1月29日時点のオリジナルよりアーカイブ。2012年2月18日閲覧。
^ Staff (2012年1月26日). “Chemists create artificial cell membrane”. kurzweilai.net. 2012年2月26日時点のオリジナルよりアーカイブ。2012年2月18日閲覧。
- ^ abcdefLombard, Jonathan (2014-12-19). “Once upon a time the cell membranes: 175 years of cell boundary research”. Biology Direct 9: 32. doi:10.1186/s13062-014-0032-7.
ISSN 1745-6150. PMC: 4304622.
PMID 25522740. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4304622/.
^ Leray, C. Chronological history of lipid center. Cyberlipid Center. Last updated on 11 November 2017. link Archived 2017-10-13 at the Wayback Machine..
^ Gorter, E.; Grendel, F. (1925). “On bimolecular layers of lipoids on the chromocytes of the blood”. J. Exp. Med. 41 (4): 439–443. doi:10.1084/jem.41.4.439. PMC: 2130960.
PMID 19868999. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2130960/.
^ S J Singer and G L Nicolson."The fluid mosaic model of the structure of cell membranes." Science. (1972) 175. 720-731.
^ Noutsi, Pakiza; Gratton, Enrico; Chaieb, Sahraoui (2016-06-30). “Assessment of Membrane Fluidity Fluctuations during Cellular Development Reveals Time and Cell Type Specificity”. PLoS ONE 11 (6): e0158313. doi:10.1371/journal.pone.0158313.
ISSN 1932-6203. PMC: 4928918.
PMID 27362860. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4928918/.
- ^ abc“Biomembranes: Structural Organization and Basic Functions”. Molecular Cell Biology (4th ed.). New York: Scientific American Books. (2000).
ISBN 978-0-7167-3136-8. オリジナルの2018-06-05時点によるアーカイブ。. https://www.ncbi.nlm.nih.gov/books/NBK21583/.
- ^ abcdeCooper, Geoffrey M. (2000). “Structure of the Plasma Membrane” (英語). The Cell: A Molecular Approach. オリジナルの2017-09-19時点によるアーカイブ。. https://www.ncbi.nlm.nih.gov/books/NBK9898/.
^ Abbott, Sarah K.; Else, Paul L.; Atkins, Taleitha A.; Hulbert, A. J. (2012-5). “Fatty acid composition of membrane bilayers: importance of diet polyunsaturated fat balance”. Biochimica Et Biophysica Acta 1818 (5): 1309–1317. doi:10.1016/j.bbamem.2012.01.011.
ISSN 0006-3002.
PMID 22285120. https://www.ncbi.nlm.nih.gov/pubmed/22285120.
^ Sinensky, M. (1974-2). “Homeoviscous adaptation--a homeostatic process that regulates the viscosity of membrane lipids in Escherichia coli”. Proceedings of the National Academy of Sciences of the United States of America 71 (2): 522–525.
ISSN 0027-8424. PMC: PMC388039.
PMID 4360948. https://www.ncbi.nlm.nih.gov/pubmed/4360948.
^ William,, Stillwell,. An introduction to biological membranes : composition, structure and function (Second edition ed.). London.
ISBN 9780444637901.
OCLC 953455850. https://www.worldcat.org/oclc/953455850.
- ^ abLodish, Harvey; Berk, Arnold; Zipursky, S. Lawrence; Matsudaira, Paul; Baltimore, David; Darnell, James (2000). “Biomembranes: Structural Organization and Basic Functions” (英語). Molecular Cell Biology. オリジナルの2018-06-05時点によるアーカイブ。. https://www.ncbi.nlm.nih.gov/books/NBK21583/.
^ Mendez, Roberto; Banerjee, Santanu (2017). “Sonication-Based Basic Protocol for Liposome Synthesis”. Methods in Molecular Biology (Clifton, N.J.) 1609: 255–260. doi:10.1007/978-1-4939-6996-8_21.
ISSN 1940-6029.
PMID 28660588. https://www.ncbi.nlm.nih.gov/pubmed/28660588.
- ^ abBrandley, B. K.; Schnaar, R. L. (July 1986). “Cell-surface carbohydrates in cell recognition and response”. Journal of Leukocyte Biology 40 (1): 97–111. doi:10.1002/jlb.40.1.97.
ISSN 0741-5400.
PMID 3011937.
^ Bruce,, Alberts, (2002). Molecular biology of the cell. Johnson, Alexander,, Lewis, Julian,, Raff, Martin,, Roberts, Keith,, Walter, Peter, (4th ed ed.). New York: Garland Science.
ISBN 0815332181.
OCLC 48122761. https://www.ncbi.nlm.nih.gov/books/NBK26941/.
^ “Membrane Structure (SWF)”. Davidson College (2002年). 2007年1月8日時点のオリジナルよりアーカイブ。2007年1月11日閲覧。
^ Lodish, Harvey; Berk, Arnold; Zipursky, S. Lawrence; Matsudaira, Paul; Baltimore, David; Darnell, James (2000). “Post-Translational Modifications and Quality Control in the Rough ER” (英語). Molecular Cell Biology. https://www.ncbi.nlm.nih.gov/books/NBK21741/.
^ Cooper, Geoffrey M. (2000). “Transport of Small Molecules” (英語). The Cell: A Molecular Approach. オリジナルの2018-06-05時点によるアーカイブ。. https://www.ncbi.nlm.nih.gov/books/NBK9847/.
^ Kramer, Eric M.; Myers, David R. (2013). “Osmosis is not driven by water dilution”. Trends in Plant Science 18 (4): 195–197. doi:10.1016/j.tplants.2012.12.001.
PMID 23298880. オリジナルの2017-09-12時点によるアーカイブ。. http://linkinghub.elsevier.com/retrieve/pii/S136013851200252X.
- ^ abAlberts, Bruce; Johnson, Alexander; Lewis, Julian; Raff, Martin; Roberts, Keith; Walter, Peter (2002). “Membrane Proteins” (英語). Molecular Biology of the Cell. オリジナルの2018-06-05時点によるアーカイブ。. https://www.ncbi.nlm.nih.gov/books/NBK26878/.
^ Alberts, Bruce; Johnson, Alexander; Lewis, Julian; Raff, Martin; Roberts, Keith; Walter, Peter (2002). “Transport into the Cell from the Plasma Membrane: Endocytosis” (英語). Molecular Biology of the Cell. オリジナルの2018-06-05時点によるアーカイブ。. https://www.ncbi.nlm.nih.gov/books/NBK26870/.
^ Salton, Milton R. J.; Kim, Kwang-Shin (1996). Baron, Samuel. ed. Medical Microbiology (4th ed.). Galveston (TX): University of Texas Medical Branch at Galveston.
ISBN 978-0963117212.
PMID 21413343. https://www.ncbi.nlm.nih.gov/books/NBK8477/.
^ Mishra, Nagendra N.; Liu, George Y.; Yeaman, Michael R.; Nast, Cynthia C.; Proctor, Richard A.; McKinnell, James; Bayer, Arnold S. (February 2011). “Carotenoid-Related Alteration of Cell Membrane Fluidity Impacts Staphylococcus aureus Susceptibility to Host Defense Peptides”. Antimicrobial Agents and Chemotherapy 55 (2): 526–531. doi:10.1128/AAC.00680-10.
ISSN 0066-4804. PMC: 3028772.
PMID 21115796. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3028772/.
^ Alexander, C.; Rietschel, E. T. (2001). “Bacterial lipopolysaccharides and innate immunity”. Journal of Endotoxin Research 7 (3): 167–202. doi:10.1177/09680519010070030101.
ISSN 0968-0519.
PMID 11581570.
^ YashRoy, R.C. (1999). “A structural model for virulence organellae of gram negative organisms with reference to Salmonella pathogenicity in chicken ileum”. Indian Journal of Poultry Science 34 (2): 213–219. オリジナルの2014-11-07時点によるアーカイブ。. https://www.researchgate.net/publication/230856732.
- ^ abSaier, Milton H. (2013). “Microcompartments and Protein Machines in Prokaryotes”. Journal of Molecular Microbiology and Biotechnology 23 (4–5): 243–269. doi:10.1159/000351625.
ISSN 1464-1801. PMC: 3832201.
PMID 23920489. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3832201/.
^ “The fluid mosaic model of the structure of cell membranes”. Science 175 (4023): 720–31. (Feb 1972). doi:10.1126/science.175.4023.720.
PMID 4333397. オリジナルの2009-02-08時点によるアーカイブ。. http://www.sciencemag.org/cgi/content/abstract/175/4023/720.
^ Kusumi, Akihiro; Shirai, Yuki M.; Koyama-Honda, Ikuko; Suzuki, Kenichi G. N.; Fujiwara, Takahiro K. (2010-05-03). “Hierarchical organization of the plasma membrane: investigations by single-molecule tracking vs. fluorescence correlation spectroscopy”. FEBS letters 584 (9): 1814–1823. doi:10.1016/j.febslet.2010.02.047.
ISSN 1873-3468.
PMID 20178787. https://www.ncbi.nlm.nih.gov/pubmed/20178787.
^ Hankins, Hannah M.; Baldridge, Ryan D.; Xu, Peng; Graham, Todd R. (2015-1). “Role of flippases, scramblases and transfer proteins in phosphatidylserine subcellular distribution”. Traffic (Copenhagen, Denmark) 16 (1): 35–47. doi:10.1111/tra.12233.
ISSN 1600-0854. PMC: PMC4275391.
PMID 25284293. https://www.ncbi.nlm.nih.gov/pubmed/25284293.
^ Albers, S. V.; van de Vossenberg, J. L.; Driessen, A. J.; Konings, W. N. (2000-09-01). “Adaptations of the archaeal cell membrane to heat stress”. Frontiers in Bioscience: A Journal and Virtual Library 5: D813–820.
ISSN 1093-9946.
PMID 10966867. https://www.ncbi.nlm.nih.gov/pubmed/10966867.
^ “Mediation, Modulation and Consequences of Membrane-Cytoskeleton Interactions”. Annual Review of Biophysics 37: 65–95. (2008). doi:10.1146/annurev.biophys.37.032807.125912.
PMID 18573073.
^ Whatley, Jean M.; John, P.; Whatley, F. R. (1979-04-11). “From Extracellular to Intracellular: The Establishment of Mitochondria and Chloroplasts” (英語). Proceedings of the Royal Society of London B: Biological Sciences 204 (1155): 165–187. doi:10.1098/rspb.1979.0020.
ISSN 0962-8452.
PMID 36620. オリジナルの2017-11-07時点によるアーカイブ。. http://rspb.royalsocietypublishing.org/content/204/1155/165.
^ Alberts, Bruce; Johnson, Alexander; Lewis, Julian; Raff, Martin; Roberts, Keith; Walter, Peter (2002). “The Structure and Function of DNA” (英語). Molecular Biology of the Cell. https://www.ncbi.nlm.nih.gov/books/NBK26821/.
^ Alberts, Bruce; Johnson, Alexander; Lewis, Julian; Raff, Martin; Roberts, Keith; Walter, Peter (2002). “The Transport of Molecules between the Nucleus and the Cytosol” (英語). Molecular Biology of the Cell. https://www.ncbi.nlm.nih.gov/books/NBK26932/.
^ Cooper, Geoffrey M. (2000). “The Endoplasmic Reticulum” (英語). The Cell: A Molecular Approach. オリジナルの2017-10-03時点によるアーカイブ。. https://www.ncbi.nlm.nih.gov/books/NBK9889/.
^ Xu, Haijiao; Su, Weiheng; Cai, Mingjun; Jiang, Junguang; Zeng, Xianlu; Wang, Hongda (2013-04-16). “The Asymmetrical Structure of Golgi Apparatus Membranes Revealed by In situ Atomic Force Microscope”. PLOS ONE 8 (4): e61596. doi:10.1371/journal.pone.0061596.
ISSN 1932-6203. PMC: 3628984.
PMID 23613878. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3628984/.
関連項目
膜タンパク質
- 受容体
イオンチャネル、膜輸送体
- Gタンパク質
関わる機能等
- エンドサイトーシス
- エキソサイトーシス
- シグナル伝達
外部リンク
細胞膜 - 脳科学辞典
| ||||||||||||